Kuis 3
Chapter 1
1. Segala sesuatu yang menempati ruang dan memiliki massa disebut ….
a. materi
b. unsur
c. senyawa
d. campuran
Jawab Materi dalam pengertian ilmu kimia merupakan segala sesuatu yang memiliki masa dan memiliki volume, atau dalam kata lain, materi adalah segala sesuatu yang menempati ruang. (A)
2. Suatu zat terdiri dari atom-atom unsur Nitrogen (N) dengan angka indeks 1 dan atom unsur hidrogen (H) dengan angka indeks 4. Penulisan senyawa tersebut yang benar adalah ….
a. NH
b. NH3
c. N2H6
d. NH4
Jawab : (D)
N = 1
H = 4
Sehingga dapat di tuliskan:
NH4
Sebenarnya dalam Ilmu kimia dituliskan
NH4+ yang merupakan zat Amonium.
Chapter 2
3. Kalium mempunyai nomor atom 19 dan nomor massa 39. Jumlah elektron pada ion Kalium adalah . . .
A. 21
B. 20
C. 19
D. 18
E. 17
Jawab : Nomor atom menunjukkan jumlah proton sama dengan jumlah elektron.(C)
4. Timbal (II) nitrat mempunyai rumus kimia ……
a. PbNO3
b. Pb2NO3
c. 2PbNO3
d. (Pb)2NO3
e. Pb(NO3)2
Jawab : (E)
Timbal(II) nitrat adalah suatu senyawa anorganik dengan rumus kimia Pb(NO3)2.
Senyawa ini umumnya dijumpai sebagai kristal tak berwarna atau serbuk putih dan, tidak seperti kebanyakan garam timbal(II) lainnya, larut dalam air.
Chapter 4
5. Jika didalam suatu larutan yang dibuat dengan melarutkan 4,5 gram glukosa (C6H12O6) dalam 100 gram air,kemolalanya adalah …. (Ar C = 12, H =1, O = 16)
a. 0,25 molal
b. 0,4 molal
c. 0,3 molal
d. 0,5 molal
e. 0,43 molal
Jawab : (A)
Mr C6H12O6 = 180
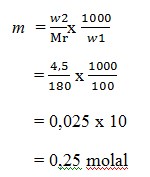
6. Jika 100 mL larutan BOH 0,1 M memiliki konsentrasi ion OH− yang sama dengan konsentrasi ion OH− dalam 50 mL larutan NaOH 0,001 M, nilai Kb BOH nya adalah…..
a. 10-5
b. 10-4
c. 10-3
d. 10-2
e. 10-1
Jawab : (A)
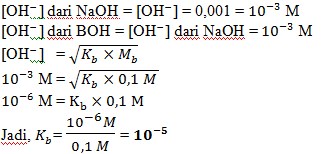
Chapter 5
7. Suatu gas ideal mula-mula menempati ruang yang volumenya V pada suhu T dan tekanan P. Jika suhu gas menjadi 3/2 T dan tekanannya menjadi 2 P, maka volume gas menjadi ….
A. 3/4 V
B. 4/3 V
C. 3/2 V
D. 3 V
E. 4 V
Jawab : (A)
8. Tekanan gas dalam ruang tertutup:
- 1) Sebanding dengan kecepatan rata-rata partikel gas.
- 2) Sebanding dengan energi kinetik rata-rata partikel gas.
- 3) Berbanding terbalik dengan volume gas.
- 4) Tidak bergantung pada banyaknya partikel gas.
Pernyataan yang benar adalah…
A. 1, 2, dan 3
B. 1, 2, 3, dan 4
C. 1 dan 3
D. 2 dan 4
E. 4 saja
Jawab : (A)
N = banyaknya partikel gas = 6,02 x 1023
V = volume gas (m3)
P = tekanan gas ideal (N/m2)
Ek = Energi kinetik gas (satuan joule).
Chapter 6
9. Suatu campuran pereaksi di dalam tabung reaksi meyebabkan tabung tersebut menjadi panas jika dipegang. Penyataan yang tepat mengenai hal tersebut adalah….
a. Entalpi pereaksi bertambah
b. Entalpi peraksi berkurang
c. Entalpi pereaksi dan hasil reaksi bertambah
d. Entalpi pereaksi lebih besar daripada entalpi hasil reaksi
e. Entalpi hasil reaksi lebih besar daripada entalpi pereaksi
Jawab : (D)
Jika suatu reaksi kimia menghasilkan panas, maka reaksi tersebut merupakan reaksi eksoterm. Pada reaksi eksoterm, entalpi reaksi bernilai negative (entalpi pereaksi lebih besar daripada entalpi hasil reaksi)
10. Jika diketahui ΔHc°C = -393,5 kJ mol‾¹ , berapa kalor yang terjadi pada pembakaran 1 kg arang, jika dianggap bahwa arang mengandung 48% karbon dan Ar C = 12?
a. 740 kJ
b. 470 kJ
c. 740 kJ
d. 470 kJ
e. 740 kJ
Jawab : (A)
ΔHc°C = -393,5 kJ mol -1
massa C = 48/100 x 1000 gram
= 480 gram
Pada pembakaran 1 mol karbon dibebaskan kalor 393,5 kJ maka pada pembakaran 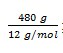 karbon dihasilkan kalor sebanyak:
karbon dihasilkan kalor sebanyak:
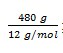 x 393,5 kJ/mol
x 393,5 kJ/mol
= 15.740 kJ
Chapter 7
11. Konfigurasi elektron dari unsur yang memiliki nomor atom 24 adalah..
A. (Ar) 4s² 3d4
B. (Ar) 3d4 4p6
C. (Ar) 4s1 3d5
D. (Ar) 3d6
E. (Ar) 4s² 4p4
Jawab : (C)
konfigurasi elektron yang memiliki nomor atom 24 adalah:
1s2 2s2 2p6 3s2 3p6 4s1 3d5
Atau (Ar) 4s1 3d5
12. Diagram orbital 2 buah unsur sebagai berikut:
Chapter 8
13. Tabel keteraturan sifat unsur dari kiri ke kanan dalam satu periode adalah sebagai berikut
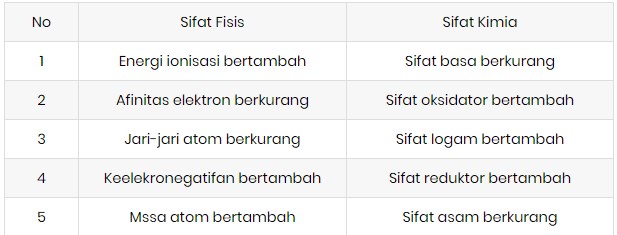
Sifat yang tepat untuk unsur-unsur periode ketiga adalah ….
a. 1
b. 2
c. 3
d. 4
e. 5
Jawab : (A)
- Dari kiri kekanan sifat unsur periode ketiga berubah dari logam-metaloid-nonlogam- dan gas mulia
- Keelektronegatifan dari kiri kekanan bertambah
- Titik cair dan titik didih dari kiri kekanan meningkat secara bertahap dan mencapai puncaknya pada silikon, kemudian turun secara drastis pada fosfor
- Energi ionisasi dari kiri kekanan cenderung bertambah
- Daya peeduksi unsur perioe ketiga dari kiri kekanan berkurang
- Daya pengoksidasinya bertambah
- Dari kiri kekanan energi ionisasi bertambah oleh karena itu sifat basa berkurang dan sifat asam bertambah
a. Logam-nonlogam-metaloid-gas mulia
b. Logam-metaloid-gas mulia-logam
c. Gas mulia-metaloi-logam-nonlogam
d. Metaloid-logam-nonlogam-gas mulia
e. Logam-metaloid-nonlogam-gas mulia
Jawab : (E)
Unsur unsur dalam satu periode tdaklah mempunyai sifat yang mirip, tetapi sifat-sifatnya berubah secara beruran. Perubahan sifat unsur-unsur dalam satu periode dapat dilihat pada unsur-unsur periode ketiga. Dari kiri kekaan sifat unsur peiode ketiga berubah yaitu dari logam-metaloid-nonlogam-gas mulia.
Chapter 9
15. Yang dimaksud dengan ikatan kovalen polar….
a. terjadi jika adanya penggunaan pasangan electron secara bersama-sama oleh atom-atom yang berikatan
b. Ikatan kovalen yang terbentuk ketika electron sekutu atom tidak benar-benar dipakai
c. Ikatan kovalen yang terbentuk ketika atom membagikan elektronnya setara (sama)
d. Ikatan kimia yang yang menggunakan pasangan electron bersama yang berasal dari salah satu atom
e. Ikatan yang terbentuk karena adanya serah terima electron
Jawab : (B)
Ikatan kovalen terbentuk karena ketika electron sekutu atom tidak benar-benar dipakai. Hal ini terjadi ketika atom mempunyai elektronegativitas yang lebih tinggi dari pada atom laiinya.
Atom yang mempunyai elektronegativitas yang tinggi mempunyai tarikan electron yang lebih kuat. Akibatnya electron sekutu lebih dekat ke atom yang mempunyai elektronegatifitas tinggi.
16. Senyawa-senyawa kovalen berikut memenuhi kaidah oktet, kecuali . . .
a. CHCl3
b. NHO3
c. H2O
d. C2H4
e. BeCl2
Jawab : (E)
Molekul BeCl2, terbentuk dari satu atom logam Be dan dua atom non logam Cl. Konfigurasi elektron atom Be, yaitu 1s2 2s2. Untuk mencapai kestabilannya mengikuti hukum oktet Lewis, atom Be seharusnya memerlukan 6 elektron tambahan.
Namun, pada kenyataannya jumlah elektron pada atom Be kurang dari 8. Ikatan yang terbentuk pada molekul BeCl2 adalah sebagai berikut:
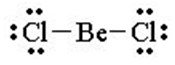
Dalam molekul tersebut, atom Be hanya mempunyai 4 elektron di kulit terluarnya. Jadi, BeCl2 tidak memenuhi hukum oktet.
Chapter 10
17. Senyawa berikut yang bersifat kovalen polar adalah . . .
a. H2O
b. CH4
c. CO2
d. N2
e. BH3
Jawab : (A)
contoh senyawa yang memiliki bentuk molekul simetris dan bersifat nonpolar, yaitu CH4, BH3, BCl3, BF3, PCl5, dan CO2. (Chemistry 1A, Nana Sutresna, Facil, 2010, h. 62)
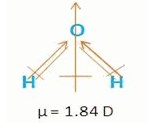
Molekul H2O mempunyai momen dipol dan bersifat polar.
18. Ramalkan kepolaran molekul dari NH3 berikut….
a. Polar
b. Non polar
c. Reaktif
d. Sangat polar
e. Benar semua
Jawab : (A)
Bentuk molekul dari NH3 adalah trigonal piramida atom N lebih elektronegatif dari atom H.
maka ikatan N-H adalah polar. Oleh karena bentuk NH3 trigona piramida dan ikatan N-H yang polar mengarah ke atas pusat N maka momen dipolnya tidak sama dengan O sehingga bersifat polar. 4. P (nomor atom 5) konfigurasi electronnya sama dengan [Ne] 3S2 3P3 supaya dapat membentuk 5 ikatan kovalen,
maka satu kovalen dari orbital 3ds harus di promosikan ke orbital 3d. selanjutnya, orbital 3s,3 orbital 3p, dan 1 orbital 3d mengalami hibridisasi membentuk orbital hibrida sp3d yang berbentuk bipiramida trigonal.
Chapter 11
19. Pernyataan yang tepat mengenai perbandingan kekuatan gaya Van Der Waals dengan ikatan hidrogen yaitu . . . . .
- (1) Pembentukan delta pada muara sungai
- (2) Pemurnian gula pasir
- (3) Penyembuhan sakit perut oleh norit
- (4) Penjernihan air
Merupakan contoh koagulasi koloid adalah …
a. 1 dan 2
b. 1 dan 3
c. 1 dan 4
d. 2 dan 3
e. 2 dan 4
Jawab : (C)
Koagulasi merupakan suatu keadaan dimana partikel-partikel koloid membentuk suatu gumpalan yang lebih besar.penggumpalan ini dikarenakan oleh beberapa faktor antara lain karena penambahan zat kimia atau enzim tertentu.
Contoh peristiwa koagulasi :
- Pembentukan delta muara sungai
- Penggumpalan karet dalam lateks dengan asam format
- Penggumpalan lumpur koloidal dalam air sungai dengan t awas
- Koagulasi asap atau debu dengan koagulator listrik
22. Gerak brown terjadi karena …
a. Gaya gravitasi
b. Tolak-menolak antara partikel koloid yang bermuatan sama
c. Tarik-menarik antara partikel koloid yang berbeda muatan
d. Tumbukan antara partikel koloid
e. Tumbukan molekul medium dengan partikel koloid
Jawab : (E)
Koloid dapat menghamburkan cahaya, jika diamati dengan miskroskop ultra, akan terlihat partikel koloid senantiasa bergerak terus menerus dengan gerakan patah-patah (zig zag) yang disebut dengan gerak brown (Robert Brown) .
Gerak brown ini terjadi disebabkan tumbukan yang tidak seimbang dari molekul-molekul medium tehadap partikel koloid. Semakin tinggi suhu semakin cepat gerak brown berlansung karena energy kinetic moleku l medium meningkat sehingga menghasilkan tumbukan yang kuat.




Tidak ada komentar:
Posting Komentar