Kuis 8
Chapter 13
1. Suatu katalis mempercepat reaksi dengan cara meningkatkan ….
a. jumlah tumbukan molekul
b. energi kinetik molekul
c. perubahan entalpi
d. energi aktivasi
e. jumlah molekul yang memiliki energi di atas energi aktivasi
Jawaban : E
Jumlah molekul yang memiliki energi di atas energi aktivasi dan menurunkan energi aktivasi sehingga reaksi dapat terjadi lebih cepat.
2. Suatu reaksi berlangsung dua kali lebih cepat setiap suhunya dinaikkan 10°C. Jika laju reaksi pada saat suhu 20°C adalah x M/detik, tentukan laju reaksi pada saat suhu dinaikkan menjadi 60°C.
a. 2x
b. 4x
c. 8x
d. 16x
e. 32x
Jawaban : D
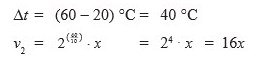
Chapter 14
3. Perhatikan reaksi berikut.
![]()
Reaksi kesetimbangan bergeser kekiri jika…
a. Konsentrasi O2 ditambah
b. Suhu diturunkan
c. Tekanan diperkecil
d. Konsentrasi NO2 dikurangi
e. Volume diperbesar
Jawaban : B
Jika suhu diturunkan reaksi kesetimbangan bergeser ke kiri. Jika suhu dinaikkan reaksi kesetimbangan bergeser kekanan.
4. Suatu sistem kesetimbangan bersifat dinamis-mikroskopis berarti…
a. Perubahan berlangsung terus-menerus dan dapat diamati
b. Reaksi terus berlangsung kekanan dan kekiri dan dapat diamati
c. Reaksi terus berlangsung kekanan dan kekiri tetapi tidak teramati
d. Perubahan berlangsung terus berhenti sehingga tidak dapat diukur
e. Perubahannya terhenti dan dapat terukur
Jawaban : C
Kesetimbangan dinamis yaitu proses bolak-balik dengan laju yang sama untuk kedua arah. Jadi reaksi berlangsung kekanan dan kekiri. Bersifat dinamis-mikroskopis maksunya hanya terjadi sedikit perubahan jadi tidak teramati.
Chapter 15
5. Dari 1 gram NaOH (Mr = 40) akan dihasilkan larutan 0,25 M sebanyak ….
- 50 ml
- 100 ml
- 125 ml
- 150 ml
- 200 ml

6. Untuk mengubah 40 ml larutan H2SO4 6 M menjadi H2SO4 5 M diperlukan tambahan air sebanyak ….
- 4 ml
- 6 ml
- 7 ml
- 8 ml
- 9 ml

Chapter 16
7. Seorang siswa memiliki beberapa jenis garam yang berbeda. Garam - garam tersebut dilarutkan dalam air kemudian diuji menggunakan indikator kertas lakmus. Garam yang dapat mengubah warna lakmus merah menjadi biru adalah ….
- amonium klorida
- barium nitrat
- natrium asetat
- kalium sulfat
- kalium bromida
Jawaban: C
Garam jika dilarutkan dalam air maka akan mengalami reaksi hidrolisis. Reaksi hidrolisis garam terbagi menjadi:
- Hidrolisis sebagian — merupakan garam yang berasal dari asam lemah dengan basa kuat (garam basa) dan garam yang berasal dari asam kuat dan basa lemah (garam asam)
- Hidrolisis sempurna — merupakan garam yang berasal dari asam dan basa lemah
- Tidak terhidrolisis — merupakan garam yang berasal dari asam dan basa kuat
Garam yang dapat mengubah warna lakmus merah menjadi biru adalah garam yang bersifat basa, yaitu garam yang berasal dari asam lemah dan basa kuat atau garam yang berasal dari asam lemah dan basa kuat dengan nilai Kb > Ka.
- amonium klorida — berasal dari amonium hidroksida (basa lemah) dan asam klorida (asam kuat) — garam asam
- barium nitrat — berasal dari barium hidroksida (basa kuat) dan asam nitrat (asam kuat) — garam netral
- natrium asetat — berasal dari natrium hidroksida (basa kuat) dan asam asetat (asam lemah) — garam basa
- kalium sulfat — berasal dari kalium hidroksida (basa kuat) dan asam sulfat (asam kuat) — garam netral
- kalium bromida — berasal dari kalium hidroksida (basa kuat) dan asam bromida (asam kuat) — garam netral
a. 10-3 M
b. 10-1 M
c. 10-2 M
d. 10-6 M
e. 10-5 M
Jawaban : A
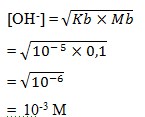
Chapter 17
9. Apa yang dimaksud dengan Adiabatik ?
10. Kalor sebanyak 2000 Joule ditambahkan pada sistem dan lingkungan melakukan usaha 2500 Joule pada sistem. Perubahan energi dalam sistem adalah…..
Chapter 18
Logam yang tidak diperoleh dengan proses elektrolisis adalah …
a. Natrium
b. Aluminium
c. Magnesium
d. Kalsium
e. Merkuri
Jawaban : E
Pembahasan :
Logam-logam Natrium, Aluminium, Magnesium, dan Kalsium diperoleh dengan proses elektrolisis, sebab logam-logam ini tergolong reduktor kuat. Logam Merkuri (Raksa) adalah logam yang berwujud cair pada suhu kamar, tidak diendapkan di Katode.
Logam ini diperoleh dengan Pemanggangan HgS atau pemanasan HgO.
Reaksinya :
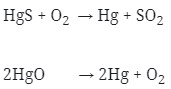


Tidak ada komentar:
Posting Komentar